 FOTO: (AP Photo/Ted S. Warren)
FOTO: (AP Photo/Ted S. Warren)
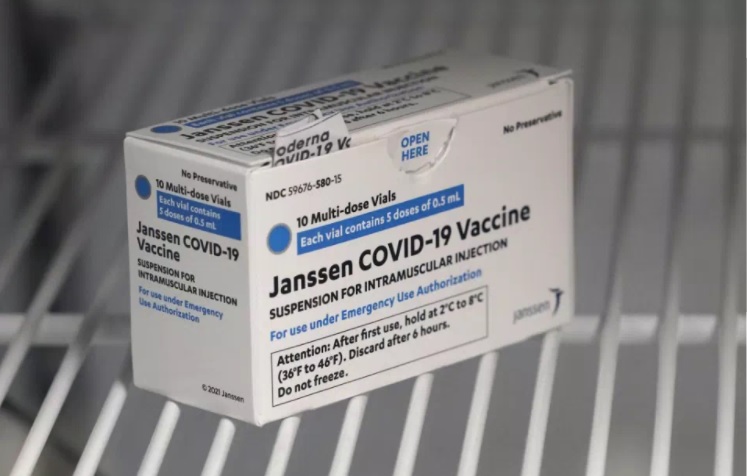
A Agência Nacional de Vigilância Sanitária (Anvisa) liberou nesta quarta-feira (31) o uso emergencial da vacina da Janssen, braço farmacêutico da Johnson & Johnson, contra o novo coronavírus.
Até o momento, três dos cinco membros da Diretoria Colegiada da agência já se manifestaram a favor do uso temporário do imunizante, garantindo a maioria necessária para aprovação do uso emergencial – os outros dois, incluindo o diretor-presidente da Anvisa, Antonio Barra Torres, ainda não votaram.
A Janssen havia solicitado o uso emergencial de seu imunizante contra a Covid-19 no Brasil na quarta-feira (24). Com a decisão da agência, a vacina pode agora ser aplicada na população brasileira.
A entrega de 38 milhões de doses do imunizante, que faz parte do Plano Nacional de Imunizações (PNI) do Ministério da Saúde, deve começar em julho – até setembro, devem ser entregues 16,9 milhões de doses; depois, de outubro a dezembro, são esperadas mais 21,1 milhões de doses.
Primeiro a se manifestar na reunião, Gustavo Mendes Lima Santos, gerente-geral de medicamentos e produtos biológicos da agência, recomendou a aprovação para uso emergencial da vacina por demonstrar “eficácia da dose única em pacientes adultos maiores de 18 anos”.
“Com base nos resultados dos estudos, é possível estabelecer um prazo de 3 meses de estabilidade do produto quando conservado em temperaturas de 2ºC a 8ºC. Recomendamos não congelar e proteger da luz porque o adenovírus é sensível e, após aberta, a vacina pode ser usada por até 6 horas, desde que armazenada entre 2ºC a 8ºC”, afirmou.
Ele afirmou que a Anvisa não observou efeitos colaterais que possam causar questões graves em razão do uso do imunizante, mas ressaltou algumas incertezas em relação ao imunizante, incluindo ausência de dados sobre uso concomitante com outras vacinas, o não estabelecimento da eficácia e segurança de longo prazo e a incerteza sobre a eficácia da vacina contra as novas variantes do novo coronavírus.
O uso do imunizante também foi recomendado pela área de Inspeção e Fiscalização Sanitária da Anvisa.
“Com base nos dados apresentados, a conclusão é que a documentação apresentada, em conjunto com todas certificações já concedidas, atendem ao determinado (…) pela Anvisa e sugere cumprimento das boas práticas que justificam o uso emergencial da vacina no atual cenário pandêmico”, afirmou Ana Carolina Moreira Marino Araújo, gerente-geral da área.
Ela afirmou que, no caso da vacina da Janssen, foram validadas 8 plantas no processo de fabricação do imunizante e que a eventual inclusão de novos locais deveria ser objeto de novo pedido de uso emergencial por parte da empresa.
Suzi Teixeira Gomes, gerente-geral de monitoramento de produtos sujeitos a Vigilância Sanitária da Anvisa, destacou que o plano de gerenciamento de risco apresentado pela Janssen-Cilag se apresenta em conformidade e parecem compatíveis com o produto apresentado até o momento.
“Uma etapa muito importante está nos estudos de segurança após autorização, que é um dos mecanismos para reduzir as incertezas já apontadas, incluindo tempo de prevenção, uso em populações específicas, interações com outros medicamentos”, apontou.


Nenhum comentário:
OS COMENTÁRIOS SÃO DE EXCLUSIVA RESPONSABILIDADE DO AUTOR.
REGRAS PARA FAZER COMENTÁRIOS:
Se registrar e ser membro do Blog; Se identificar (não ser anônimo); Respeitar o outro; Não Conter insultos, agressões, ofensas e baixarias; A tentativa de clonar nomes e apelidos de outros usuários para emitir opiniões em nome de terceiros configura crime de falsidade ideológica; Buscar através do seu comentário, contribuir para o desenvolvimento.